Autofluorescencja dna oka (fundus autofluorescence – FAF) – nieinwazyjne badanie siatkówki – wykorzystuje zdolność fluoroforów, czyli cząsteczek cechujących się zdolnością do autofluorescencji, do emisji światła po pobudzeniu określoną długością fali.

Źródła FAF w siatkówce/naczyniówce
RPE
Źródło FAF w obrębie gałki ocznej stanowią przede wszystkim fluorofory, produkty metabolizmu zewnętrznych segmentów fotoreceptorów (photoreceptor outer segments – POS) przez komórki nabłonka barwnikowego siatkówki (retinal pigment epithelium – RPE). W normalnych warunkach POS zostają sfagocytowane, a tylko nieliczne produkty resztkowe (przede wszystkim bisretinoid A2E), będące fragmentami POS, powodują naturalną autofluorescencję RPE. W procesie starzenia się komórek fagocytoza POS jest niepełna i prowadzi do akumulacji produktów resztkowych, zwłaszcza lipofuscyny. Nagromadzenie tej substancji w RPE jest z kolei źródłem znacznie wzmożonej autofluorescencji i znakiem rozpoznawczym chorób degeneracyjnych oraz dystrofii siatkówki. Lipofuscyna i A2E emitują fale o długości 560–575 nm przy pobudzeniu światłem o długości fali 430–450 nm. Jest to krótkofalowy typ autofluorescencji (short wave FAF – SW-FAF).
Fluorofory poza RPE
W niektórych przypadkach dochodzi do akumulacji fluoroforów poza obrębem RPE. Typowe przykłady to zwyrodnienie żółtkowate dorosłych (adult-onset vitelliform macular dystrophy – AVMD) oraz centralna surowicza chorioretinopatia (central serous chorioretinopathy – CSCR). W tych chorobach POS oddziela się od RPE, w związku z czym jego metabolizm odbywa się pozakomórkowo. Fluorofory z POS znajdują się w produktach resztkowych kumulowanych pod siatkówką sensoryczną w AVMD oraz w płynie podsiatkówkowym w CSCR.
Melanina
Poza fluoroforami zdolność do autofluorescencji cechuje również melaninę. Typowo barwnik ten występuje w melanosomach RPE oraz naczyniówki. W przeciwieństwie do lipofuscyny melanina emituje światło po wzbudzeniu falą o większej długości i jest źródłem tzw. fluorescencji w bliskiej podczerwieni (near infrared FAF-NIR – FAF). Natomiast w SW-FAF melanina absorbuje światło i wpływa na zmniejszenie sygnału FAF (ogniska hipoautofluorescencji).
Inne
W gałce ocznej występują również inne fluorofory, np. pozakomórkowe produkty resztkowe pochodzenia mitochondrialnego, stanowiące źródło autofluorescencji w przebiegu druz tarczy nerwu wzrokowego.
Uwaga!
Zdolność do fluorescencji cechuje także inne struktury gałki ocznej, takie jak rogówka czy soczewka. Co prawda zdolność do emisji światła przez te struktury ujawnia się przy pobudzeniu krótszą długością fali, w porównaniu z fluoroforami RPE, ale nadal fluorescencja ze struktur położonych przed siatkówka może się nakładać na FAF i tym samym wpływać na zakłócenia w obrazach FAF. Interferencje te można wyeliminować, stosując filtry z przesunięciem w kierunku czerwonej części widma oraz laserową konfokalną oftalmoskopię (scanning laser ophthalmoscopy – SLO).
Urządzenia badające FAF
Badanie FAF jest procedurą bardzo prostą i nieinwazyjną – polega na wykonaniu fotografii/skanu dna oka za pomocą fundus kamery z użyciem odpowiednich filtrów pobudzających oraz odcinających. Klasyczne optyczne fundus kamery wykorzystują zwykle filtry pobudzające 535–585 nm oraz odcinające 615–715 nm. W przypadku systemów obrazowania z SLO do pobudzenia fuoroforów używa się fali o długości 488 nm i rejestruje emisję fal o długości 500–700 nm. Zaletę użycia konfokalnego światła w SLO stanowi eliminacja zakłóceń związanych z odbiciem i rozproszeniem wiązki światła w klasycznych systemach optycznych. Dodatkowo za pomocą SLO można uzyskać precyzyjny obraz z określonej głębokości siatkówki. Najczęściej uzyskany skan jest efektem matematycznej analizy od kilku do kilkunastu skanów wykonanych w tym samym miejscu siatkówki. Obrazy FAF z systemów SLO cechuje więc lepsza rozdzielczość i mogą być prostsze w interpretacji. Badanie FAF w systemach SLO jest możliwe w trybie szerokokątnym (ultra wide field – UWF), np. w urządzeniach OPTOS lub Heidelberg UWF system.
Podstawowe pojęcia używane w opisywaniu obrazów FAF
Do opisywania obrazów FAF stosuje się pojęcia podobne do tych stosowanych w angiografii naczyń siatkówki. A zatem mówi się o hiperfluorescencji (hiperautofluorescencji), hipofluorescencji (hipoautofluorescencji) oraz izofluorescencji (izoautofluorescencji).
Poniżej przedstawiono najważniejsze zmiany lub jednostki kliniczne wykazujące się hipo- oraz hiperautofluorescencją.
Hiperautofluorescencja
1. Związana z akumulacją lipofuscyny:
a.Choroba Stargardta, dystrofie wzorzyste
b. Przedarcie RPE
2. Związana z obecnością fluoroforów poza RPE, pod siatkówką sensoryczną:
a. AVMD
b. CSCR
3. Związana z brakiem maskowania w przypadku utraty pigmentu plamkowego (mechanizm ubytku okienkowego):
a. MACTEL 2
b. CSCR (czasami)
c. Zespoły białoplamiste
4. Inne:
a. Druzy tarczy nerwu wzrokowego
b. Astrocytoma
Hipoautofluorescencja
1. Związana z ubytkami w RPE:
a. Atrofia RPE
b. Przedarcie RPE
2. Związana z blokadą autofluorescencji przez materiał obecny przed RPE:
a. Zmętnienia ośrodków optycznych
b. Pigment plamkowy (karotenoidy) – fizjologicznie
c. Krwotoki
d. Tkanka bliznowata
Autofluorescencja dna oka w ważniejszych jednostkach chorobowych
Poniżej przedstawiono najważniejsze cechy obrazów FAF w wybranych jednostkach klinicznych. Opis dotyczy SW-FAF, która jest najczęściej stosowaną odmianą FAF. W niektórych przypadkach wspomniano o obrazach NIR-FAF, ale wówczas trzeba wyraźnie podkreślić, że chodzi o ten drugi typ FAF.
Zwyrodnienie plamki żółtej związane z wiekiem (AMD)
Postać sucha AMD
Podstawowe elementy postaci suchej AMD obejmują druzy, zaburzenia barwnikowe (zaniki i hiperpigmentacje) oraz druzenoidalne odwarstwienia nabłonka barwnikowego siatkówki (pigment epithelial detachment – PED). Obraz druz w FAF może być bardzo zróżnicowany i praktycznie uniemożliwia precyzyjny opis obrazowania druz w FAF. Małe druzy często pozostają niewidoczne na zdjęciach FAF, choć w obrazie klinicznym dna oka obrazowane są bardzo wyraźnie. Dotyczy to przede wszystkim małych i średnich druz twardych, niepowodujących znacznych ubytków w RPE. W obrazowaniu FAF najczęściej są uwidocznione druzy większe, typowo druzy miękkie (>125 μm) – jako ogniska umiarkowanej hiperautofluorescencji o nieostrych, ale wyraźnych granicach. W przypadku druzenoidalnych PED zwykle ma się do czynienia z niehomogenną autofluorescencją w postaci obszarów hipo- i hiperautofluorescencji. Warto przypomnieć, że obraz FAF przy obecności druz odzwierciedla stan fotoreceptorów położonych bezpośrednio nad nimi. Tak więc obecność zaburzeń autfluorescencji na dnie oka może tłumaczyć upośledzenie funkcji wzrokowych w suchej postaci AMD.
Szczególne miejsce wśród druz obserwowanych w FAF zajmują druzy siateczki, zwane też pseudodruzami (reticular pseudodrusen) lub podsiatkówkowymi druzenoidalnymi złogami (subretinal drusenoid deposits – SDD). Morfologicznie SDD są zlokalizowane pomiędzy RPE a siatkówką sensoryczną, tak więc nie są to druzy sensu stricto. Oftalmoskopowo SDD są widoczne jako drobne żółtawe depozyty. W FAF SDD przyjmują kształt drobnych (zwykle <200 µm), okrągłych lub owalnych ognisk hipoautofluorescencji otoczonych obszarem normalnej autofluorescencji. W niektórych przypadkach dokładna analiza FAF w SDD wykazuje, że mogą one przypominać tarczę – izoautofluorescencyjne centrum otoczone hipoautofluorescencyjnym „halo”. FAF wykazuje bardzo wysoką czułość detekcji SDD, sięgającą nawet 90%. Ma to istotne znaczenie rokownicze, ponieważ ich obecność kojarzy się z większym ryzykiem progresji AMD oraz jego konwersją w postać wysiękową (neovascular AMD – nAMD).
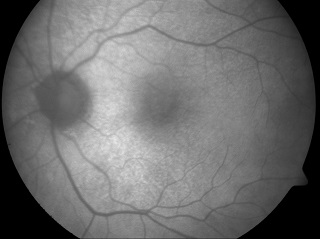
Ryc. 1. Obraz FAF druz siateczki w biegunie tylnym. Widoczne drobne ogniska hipoautofluorescencji w rzucie druz.
Skupiska barwnika – często widoczne w suchej postaci AMD – typowo prezentują się w FAF jako ogniska lub linie hiperautofluorescencji. Zmiany te są przypisywane melanolipofuscynie zawartej w tych skupiskach. W przypadku samej melaniny, jak wspomniano wcześniej, może nastąpić izoautofluorescencja lub nawet blokada SW-FAF. Zmiany są natomiast widoczne w obrazach NIR-FAF.
Analizując całość obrazu FAF we wczesnych postaciach AMD, wyodrębniono określone typy – schematy autofluorescencji (Bindewald et al. 2005); są to: typ normalny (brak zmian), minimalny (minimal change), ogniskowy (focal increased), plackowaty (patchy), linearny (linear), koronkowaty (lacelike), retikularny (reticular) oraz plamisty (speckled). W dalszej kolejności zdefiniowano fenotypy, które wykazują większe ryzyko progresji do zaawansowanych form AMD, przede wszystkim konwersję do postaci wysiękowej (Batioglu et al. 2014). Analiza wykazała, że najczęściej MNV (macular neovascularization) rozwija się w przypadku fenotypu plackowatego, linearnego oraz retikularnego (z obecnością druz siateczki). Typ plackowaty odpowiada najczęściej obecności plackowatych obszarów hiperautofluorescencji odpowiadających dużym druzom miękkim (>200 μm) lub przegrupowaniom barwnika. W schemacie linearnym można stwierdzić przynajmniej jedną hiperautofluorescencyjną zmianę o podłużnym, linijnym kształcie, zwykle odpowiadającą zmianie o charakterze hiperpigmentacji w badaniu dna oka. Z kolei typ retikularny FAF odpowiada obecności druz siateczki (SDD).
Zmiany zanikowe RPE w FAF są widoczne jako obszary o obniżonym sygnale autofluorescencji. Szczególnie istotne i precyzyjnie opisane są schematy FAF związane z obecnością zaniku geograficznego RPE (GA). Badanie grupy prof. Holza (Am J Ophthalmol 2007) wykazało, że istotne znaczenie dla rokowanej progresji GA ma obraz FAF, przede wszystkim na granicy zaniku RPE i zdrowej siatkówki. Brak zmian lub obecność tylko ogniskowych zmian o charakterze hiperautofluorescencji na brzegu obszaru zaniku RPE rokuje łagodniejszy przebieg schorzenia w porównaniu z sytuacją, kiedy hiperautofluorescencyjne zmiany na granicy zaniku mają charakter rozsiany, pasmowaty lub plackowaty – wtedy progresja jest znacząco szybsza.
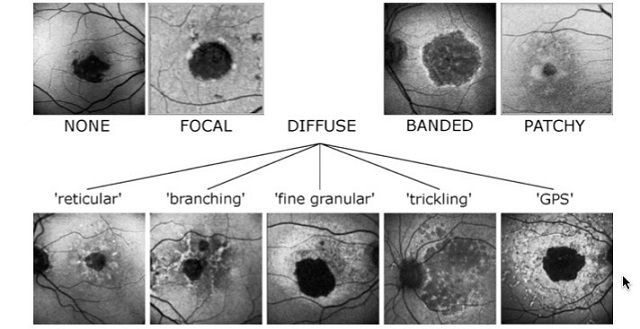
Ryc. 2. Schematy autofluorescencji wykrywanej w przebiegu zaniku geograficznego RPE; za: Holz FG, Bindewald-Wittich A, Fleckenstein M, Dreyhaupt J, Scholl HP, Schmitz-Valckenberg S.: Progression of geographic atrophy and impact of fundus autofluorescence patterns in age-related macular degeneration. Am J Ophthalmol 2007;143 (3): 463–72.
Wysiękowa postać AMD (nAMD)
W wysiękowej postaci AMD obraz FAF może być zróżnicowany i zależy od zaawansowania choroby oraz proporcji zmian morfologicznych typowych dla tej choroby (krwotoki, płyn podsiatkówkowy, elementy włókniste). W praktyce klinicznej FAF w nAMD ma znaczenie pomocnicze i w tej postaci nie funkcjonuje precyzyjna klasyfikacja określonych fenotypów. Można wyodrębnić pewne typowe cechy FAF w nAMD. Wczesne formy nAMD zlokalizowane pod RPE (MNV 1) w FAF mogą nie dawać objawów. Dopiero progresja zmian w kierunku RPE, pojawienie się płynu podsiatkówkowego (subretinal fluid – SRF) oraz włóknienia znajdują odzwierciedlenie w obrazach FAF. SRF we wczesnych postaciach nAMD zwykle powoduje hiperautofluorescencję w obszarze swojego występowania. Jednak w przypadkach bardziej zaawansowanych z progresją MNV i uszkodzeniem RPE cały kompleks włóknisto-naczyniowy powoduje blokadę autofluorescencji i widoczny jest jako obszar hipoautofluorescencyjny. Wówczas interesujące objawy FAF występują na granicy tej blokady – można stwierdzić obszary hiperautofluorescencji odpowiadające dysfunkcji RPE i akumulacji produktów resztkowych lub ze „stłoczeniem” lub sfałdowaniem RPE na granicy błony, co skutkuje wzmożonym sygnałem FAF. Po odniesieniu objawów FAF do znanych typów MNV opisywanych w SOCT można uogólnić, że większość przypadków MNV2, czyli najczęściej klasycznych błon neowaskularnych, wykazuje blokadę autofluorescencji. Jest to logiczne, gdyż lokalizacja MNV nad RPE musi wpływać na blokadę sygnału. W dużym odsetku przypadków takiemu obszarowi hipoautofluorescencji towarzyszy „halo” hiperautofluorescencji. Z kolei w przypadku MNV 1, czyli najczęściej błon ukrytych według klasyfikacji angiograficznej, obserwuje się większe zróżnicowanie, w zależności od ekspansji błony. Częściej zdarzają się tutaj obszary RPE zachowanego, ale zmienionego, który stanowi źródło hiperautofluorescencji. Większość błon typu MNV 1 prezentuje niehomogenną autfluorescencję z obszarami hipo- i hiperautofluorescencji.
Użyteczny diagnostycznie obraz uzyskuje się w badaniu FAF w przedarciach RPE, często skojarzonych z wysiękową postacią AMD. Typowo w miejscu braku RPE występuje obszar hipoautofluorescencji, natomiast na granicy ubytku zwykle dochodzi do zrolowania RPE, co w FAF jest widoczne jako obszar hiperautofluorescencji. Badanie FAF może być użyteczne w monitorowaniu ewolucji przedarcia, przede wszystkim jego regeneracji i ponownym uzupełnieniu ubytku; może to mieć miejsce w przypadkach niepowikłanych MNV lub w nAMD leczonym iniekcjami anty-VEGF.
Trzeba także podkreślić, że z powodu dużej zmienności obrazów FAF w nAMD nie jest to w tej chorobie podstawowe narzędzie diagnostyczne, a ma znaczenie typowo pomocnicze.
Dystrofie dziedziczne
Choroba Stargardta i fundus flavimaculatus
Badanie FAF to obecnie podstawowe narzędzie diagnostyczne w dziedzicznych chorobach siatkówki przebiegających z zaburzeniami metabolizmu fluoroforów oraz akumulacją lipofuscyny. Wśród młodzieńczych lub dziecięcych postaci tych chorób na pierwszym miejscu należy wymienić chorobę Stargardta, rozwijającą się w wyniku mutacji genu ABCA4, co prowadzi do upośledzenia degradacji POS oraz akumulacji lipofuscyny w komórkach RPE.
Klinicznie choroba Stargardta przebiega z centralnym zanikiem RPE i choriokapilar oraz obecnością obwodowych żółtych ognisk o przecinkowanym kształcie. Obraz kliniczny zależy od zaawansowania schorzenia – centralny zanik może mieć charakter głębokiego ubytku lub ma umiarkowane nasilenie. Zmiany tego typu są bardzo dobrze odzwierciedlone w badaniu FAF. Centralnemu zanikowi odpowiada obszar hipoautofluorescencji. Z kolei komórki obładowane lipofuscyną zlokalizowane na obwodzie wykazują hiperautofluorescencję, chociaż często w ich pobliżu zlokalizowane są ubytki w RPE – ogniska hipoautofluorescencji. Warto zwrócić uwagę na charakterystyczny wczesny objaw choroby Stargatdta – tzw. peripapillary sparing. Obszar wokół tarczy nerwu wzrokowego pozostaje niezmieniony, pomimo zmian widocznych w centralnej i obwodowej części siatkówki. Objaw ten jest szczególnie wyraźnie widoczny w NIR-FAF.
Odmianę choroby Stargardta występującą u osób starszych niż w wieku dziecięcym stanowi fundus flavimaculatus. Schorzenie podlega tej samej patogenezie jak choroba Stargardta, ale zmiany częściej dotyczą obwodu siatkówki; rzadziej występuje centralny zanik geograficzny RPE.
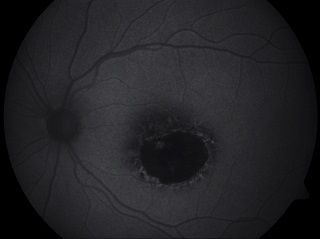
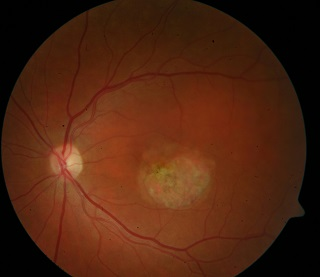
Ryc. 3. Centralna postać choroby Stargardta. Widoczny obszar hipoautofluorescencji w centralnej części siatkówki oraz pojedyncze drobne ogniska hiperautofluorescencji na granicy zaniku.
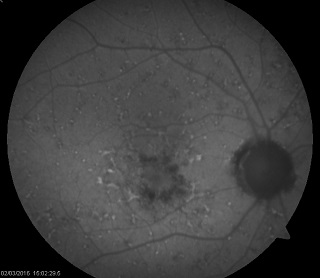
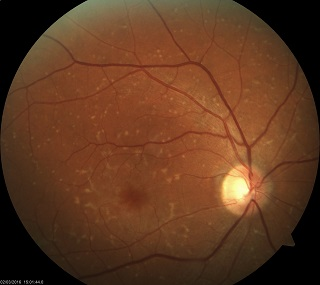
Ryc. 4. Obraz FAF w fundus flavimaculatus. Widoczne liczne drobne przecinkowate ogniska hiperautofluorescencji odpowiadające skupiskom lipofuscyny w komórkach RPE oraz pojedyncze ogniska hipoautofluorescencji w rzucie zaników RPE.
Choroba Besta
Zaburzenia obserwowane w rozpoczynającej się w wieku dziecięcym chorobie Besta są skutkiem mutacji genu BEST1. W efekcie defektów metabolicznych spowodowanych tą mutacją dochodzi do akumulacji produktów resztkowych POS oraz lipofuscyny w RPE, a także pomiędzy RPE i siatkówką sensoryczną. W początkowej fazie choroby widoczne jest duże żółte ognisko podobne do żółtka jajka, zlokalizowane obustronnie w centrum plamki. Zmiana przechodzi charakterystyczną ewolucję poprzez stadium żółtkowate, następnie tzw. pseudohypopyon, obraz „jajecznicy”, aż do stadium atrofii oraz bliznowacenia. Na podstawie obrazów FAF można określić zaawansowanie zaburzeń fluoroforów, a przede wszystkim proporcji zaniku RPE do całej zmiany. W obrazie FAF można zaobserwować kilka schematów: brak zmian, typ hipoautofluorescencyjny, typ hiperautofluorescencyjny, typ plackowaty (mieszany), wieloogniskowy oraz szprychowaty. Najczęściej spotyka się typ plackowaty (mieszany) oraz hiperautofluorescencyjny.
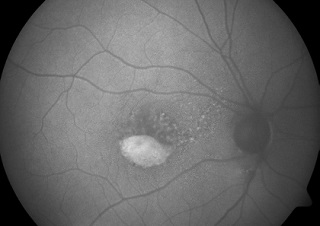
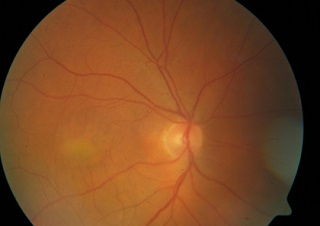
Ryc. 5. Choroba Besta w FAF: stadium pseudohypopyon.
Maciej Gawęcki
maciej@gawecki.com
